Actividades


Los iones son átomos o grupos con carga eléctrica. los iones pueden ser de ods tipos:
cationes: si presentan carga negativa.
Aniones: si presentan carga negativa.
Cationes
Pueden ser monoatómicos y poliatómicos ( N H4 + amonio).
Los monoatómicos lo forman los metales. El valor de la carga positiva coincide con la valencia del metal.
Para nombrarlos, si presenta una valencia Catión (nombre del elemento)
Si presenta 2 valencias (OH)2Fe (OH)3Fe
hidroxido hidroxido
ferroso ferrico
Aniones
Tambien se clasifican en monoatómicos y poliatómicos
H2S ------------>S-2 Anion sulfuro
Anion sulfhidrico
Sulfuro de hidrogeno
-2
H2 SO4 --------> SO4 Anion sulfato
Ac sulfçurico
-1
H2 NO2--------> NO2 Anion nitrito
Ac nitroso
Para nombrar estos aniones tenemos prescentes las siguiientes reglas:
oso bonito
pico de pato = es desir:
Hidruros ácidos
Es el producto de la reacción del hidrogeno con los sigientes elementos NO METALICOS
fluor,cloro,yodo,bromo,azufre,selenio,telurio.
Estos compuestos trabajan siempre con estas valencias.
F2 S
Cl2 valencia 1 Se valencia 2
Br2 Te
I2
En la formula el compuesto no metal se escrive a la derecha y el hidrogeno a temperatura ambiente. Estas sustancias son gases y se nombran de la siguiente manera:
(nombre del elemento)- uro de hidrogeno
H2 S sulfuro de hidrogeno
Cuando se disuelbe en agua, la soluciones de estos compuestos son acidos.
En este caso el nombre de estos compuestos es el sigiente
acido( nombre del elemento)- hidrico
Acido sulfhidrico
Hidruros Metalicos
Es el resultado de la combinación entre un metal y el hidrogeno. En la formula de los hidruros metalicos se escribe el metal a la izquierda y el hidrogeno a la derecha. Por ej= hidruro de sodioNa1 H1
Para nombrarlos, se tiene en cuenta la cantidad de valencias con las que trabaja el elemento, es desir:
1 valencia------> hidruro de Ej: hidruro de Calcio. Ca H2
2 valencias
 |
(no metales) Oxido ácido + H2O -------) acidos
-------) H elemento O
Ej: F2 O1 ----------)2 H1 F1 O1
----------)H1 F O1
(metales) Oxido básico + H2O -------> hidroxido
Ej: Li2 O1 + H2O ------->2(OH)1Li
Oxido de Litio Hidroxido de Litio
no metal + O2 ---------> Oxidos ácidos
Ej:2F2 + -----------> 2F2 O1 A=Oxido de fluor
F-- O M=Monoxido de difluor
F/ S=Oxido dev fluor (I)
Metal + O2 ---------> Oxido básico
Ej: (I) 4 Ag + O2 ------>2 Ag2 O1 A=oxido de plata
Ag --- O M=Monoxido de plata
Ag / S=Oxido de plata (I)
Nomenclatura: Se denomina a la forma de nombrar los compuestos formados en una reacción quimica. Se conocen basicamente tres maneras de nombrarlo:
Antigua: Para nombrarlos hay que ver:
Moderna: Se dice directamente la cantidad de elementos presentes en el compuesto formado, anteponiendolo al nombre del elemento que vamos a nombrar:
Ej: Cl=O7 Heptoxido de dicloro.
Stoke:Directamente se escribe el nombre completo, agragandole al final y entre parentesis y en numeros romanos la valencia con la que trabajo el elemento, en general ( Nombre del elemento) ( Valencia en numeros romanos)
stoke= Cl O7 oxido de cloro(VII)
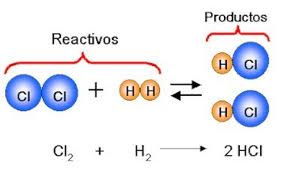
Reacción Quimica: Una reacción quimica es un proceso por el cual se combinan dos o mas sustancias simples o compuestas, que por medio de un fenómeno quimico van a generar nuevos compuestos. Consta de tres partes fundamentales:
Intramoleculares:
Intermoleculares:Son los enlaces considerados como no puros, y es la unión que se presenta molecula a molecula. Se divide en dos:
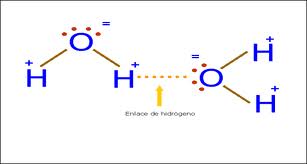
Unión Puente de Hidrogeno: Cuando se tiene el caso de que un átomo de hidrógeno esta unido por unión covalente a un átomo muy electronegativo, por ejemplo el óxigeno, se produce una polaridad en el enlace, ya que el elemento electronegativo atrae hacia sí tanto sus electrones como tambien los del hidrogeno, quedando este con una densidad de carga positiva, y el otro atamo con una densidad de carga negativa. Estas diferencias de carga permite que se produzcan uniones o atracciones entre cargas opuestas entre dos moleculas distintas.
Fuerzas de Van der Waals: Se originan cuando momentaniamente se produce un bipolo en un átomo producido este por el movimiento constante del átomo en donde se va a inducir la unión a otro átomo que también genera otro bipolo, y así sucesivamente formandose una unión débil que va a durar el tiempo que el átomo se encuentre en esta posición.

¡Hola amigos! Les damos la bienvenida a nuestro blog. En este blog brindaremos informacion acerca de una de nuestras materias, ella es "Quimica". Ella es una materia muy interesante. Preste mucha atencion, gracias a esta informacion usted ampliara sus conocimientos.
Esperamos que les guste.. :)